Forskjellen mellom benzen og fenyl
 Share
Share
Hovedforskjellen - Benzen vs Phenyl
Aromatiske forbindelser er forbindelser som har ringstrukturer sammensatt av alternerende enkelt- og dobbeltbindinger i den ringen. De fleste av de aromatiske forbindelsene er sammensatt av benzenringer. Fenyl er et derivat av benzen. Hovedforskjellen mellom benzen og fenyl er det benzen består av seks hydrogenatomer mens fenyl er sammensatt av fem hydrogenatomer.
Nøkkelområder dekket
1. Hva er benzen
- Definisjon, struktur, egenskaper, applikasjoner
2. Hva er fenyl
- Definisjon, struktur, egenskaper, applikasjoner
3. Hva er likhetene mellom benzen og fenyl
- Oversikt over vanlige funksjoner
4. Hva er forskjellen mellom benzen og fenyl
- Sammenligning av nøkkelforskjeller
Nøkkelbetingelser: Aromatiske forbindelser, benzen, elektrofil, nukleofil, fenol, fenyl

Hva er benzen
Benzen er et fargeløst, flyktig, flytende hydrokarbon til stede i petroleum. Det er en ringstruktur. De kjemisk formel av benzen er C6H6. Alle karbonatomene er bundet med hverandre gjennom tre enkeltbindinger og tre dobbeltbindinger som er ordnet på en alternativ måte. De seks hydrogenatomer er festet til de seks karbonatomer, en per hver karbon. På grunn av tilstedeværelsen av dobbeltbindinger kombineres elektronene i π-bindingene sammen, og danner to elektronmolder plassert på toppen og bunnen av benzenringen. Elektron-skyen er parallell med benzenringens plan. Denne strukturen av benzen ble først foreslått av Kekule (1872), så det kalles som Kekule struktur.

Figur 1: Struktur av benzen
Alle karbonatomer i benzenringen er sp2 hybridisert. Selv om bindelengden på C-C-enkeltbinding er større enn C = C dobbeltbinding generelt, er alle bindingene i benzen av samme lengde. På grunn av dannelsen av elektronskyger er bindelengden av benzen et sted mellom lengden på et enkeltbinding og en dobbeltbinding. Benzen er en plan struktur, og den kan brukes til syntese av mange andre avanserte forbindelser på grunn av tilgjengeligheten for substitusjoner på ringen.

Figur 2: To elektronblokker av benzen
Bensenringen er rik på elektroner. Således er benzen tilstrekkelig nukleofilt. Derfor er den store reaksjonen som benzen kan gjennomgå, elektrofil substitusjon. Benzen kan dele sine elektroner med elektrofiler. Elektrofile komponenter er molekyler som mangler elektroner for å bli stabile.
Hva er fenyl
Fenyl er en gruppe avledet fra benzen, og den kan kombineres med et annet molekyl. De kjemisk formel av fenylgruppe er C6H5. Den er også sammensatt av alternerende dobbeltbindinger som de samme som i benzenring. Fenylgruppen har et ledig punkt hvor et hydrogenatom mangler. Derfor kan denne gruppen bli festet til et annet molekyl gjennom dette punktet. Dette gjør fenylgruppen svært reaktiv.
Noen tror at fenylgruppen og benzylgruppen er de samme. Men de er veldig forskjellige fordi benzylgruppen har en -CH2- gruppe festet til benzenringen.
Det vanligste molekylet der fenylgruppen er funnet er fenol. Der er fenylgruppen bundet med -OH-gruppe.
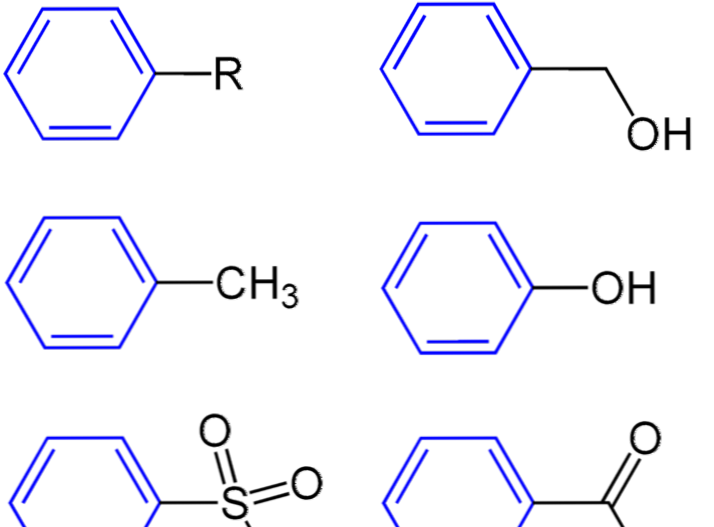
Figur 3: Fenylgruppe (i blå farge)
- Figur 3: Fenylgruppe (i blå farge)
Likheter mellom benzen og fenyl
- Begge molekylene består av seks karbonatomer.
- Begge er ringstrukturer.
- Begge er flate strukturer.
- Hybridisering av karbonatom er sp2 i både benzen og fenyl.
- Båndlengden mellom karbonatomer er lik (1,4 A0).
Forskjellen mellom benzen og fenyl
Definisjon
benzen: Benzen er et fargeløst, flyktig, flytende hydrokarbon til stede i petroleum.
fenyl: Fenyl er en gruppe avledet fra benzen, og den kan kombineres med et annet molekyl.
Antall hydrogenatomer
benzen: Benzen har seks hydrogenatomer.
fenyl: Fenyl har fem karbonatomer.
Stabilitet
benzen: Benzen er stabil når det er alene.
fenyl: Fenyl er ikke stabil alene.
Kjemisk formel
benzen: Den kjemiske formelen av benzen er C6H6.
fenyl: Den kjemiske formel for fenyl er C6H5.
Konklusjon
Benzen er mye brukt i syntesen av forskjellige viktige forbindelser. Men forsiktighet bør tas når man velger benzen for produkter som har nært forhold til konsumet. Det er fordi det har blitt oppdaget at benzen har kreftfremkallende virkninger. Fenyl er en substituent avledet fra benzen. Hovedforskjellen mellom benzen og fenyl er at benzen består av seks hydrogenatomer, mens fenyl består av fem hydrogenatomer.
referanser:
1. "The Phenyl Group." Chemistry LibreTexts. NP., 21. juli 2016. Web. Tilgjengelig her. 21. juni 2017.
2. "Fenyl eller benzyl". Hunt, Ian R. Benzen som en substituent. N.p., n.d. Web. Tilgjengelig her. 21. juni 2017.
Bilde Courtesy:
1. "Benzen Structural Diagram" Av Vladsinger - Eget arbeid (Public Domain) via Commons Wikimedia
2. "Fenylgruppe Generelle Formler V" Von Jü - Eigenes Werk (CC0) via Commons Wikimedia
3. "Benzene Quadrupole" Av Michael.hell på engelskspråk Wikipedia (CC BY-SA 3.0) via Commons Wikimedia

